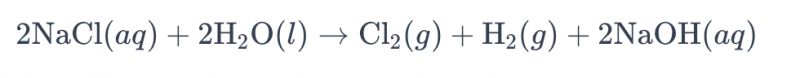Die proses van elektrolise van 'n pekeloplossing met behulp van titaniumelektrodes om chloor te produseer, word algemeen na verwys as "elektrolise van pekelwater". In hierdie proses word titaniumelektrodes gebruik om die oksidasiereaksie van chloriedione in die pekelwater te vergemaklik, wat lei tot die opwekking van chloorgas. Die algehele chemiese vergelyking vir die reaksie is soos volg:
In hierdie vergelyking ondergaan chloriedione oksidasie by die anode, wat lei tot die produksie van chloorgas, terwyl watermolekules by die katode gereduseer word, wat waterstofgas lewer. Daarbenewens ondergaan hidroksiedione reduksie by die anode, wat waterstofgas en natriumhidroksied vorm.
Die keuse van titaniumelektrodes is te danke aan titanium se uitstekende korrosieweerstand en geleidingsvermoë, wat dit toelaat om stabiel tydens elektrolise te reageer sonder korrosie. Dit maak titaniumelektrodes 'n ideale keuse vir die elektrolise van pekelwater.
Die elektrolise van soutwater vereis tipies 'n eksterne kragbron om energie vir die elektrolitiese reaksie te verskaf. Hierdie kragbron is gewoonlik 'n gelykstroom (GS) kragbron omdat elektrolitiese reaksies 'n konstante rigting van stroomvloei noodsaak, en 'n GS-kragbron kan 'n konstante stroomrigting lewer.
In die proses van elektrolise van soutwater om chloorgas te genereer, word 'n laespanning-GS-kragtoevoer algemeen gebruik. Die spanning van die kragtoevoer hang af van spesifieke reaksietoestande en toerustingontwerp, maar wissel gewoonlik tussen 2 en 4 volt. Daarbenewens is die stroomintensiteit van die kragtoevoer 'n belangrike parameter wat bepaal moet word op grond van die grootte van die reaksiekamer en die verlangde produksie-opbrengs.
Kortliks, die keuse van kragtoevoer vir die elektrolise van soutwater hang af van die spesifieke vereistes van eksperimente of industriële prosesse om doeltreffende reaksie en die bereiking van die verlangde produkte te verseker.
Plasingstyd: 16 Januarie 2024